Kolagen – święty graal czy placebo?
Wiele jest opinii twierdzących, że suplementacja kolegenu nie ma sensu, gdyż jego cząstka jest zbyt duża, by mogła przeniknąć do osocza, lub jest on w całości trawiony w żołądku.
Liczne badania wskazują jednak na to, że nutriceutyki z kolagenem korzystnie wpływają na poprawę elastyczności i nawilżenia skóry.
Jak więc jest to możliwe i czy suplementacja kolagenu ma sen?
Wprowadzenie
Jednym z najbardziej „popularnych” i najważniejszych naturalnych polimerów, występujących niemalże we wszystkich tkankach człowieka jak i innych kręgowców, jest kolagen. Stanowi on aż 33% białek organizmu człowieka i jest głównym składnikiem substancji pozakomórkowej ECM (Extracellular Matrix). Jego wszechobecność w organizmie (skóra, ścięgna, kości, chrząstki, ściany naczyń krwionośnych, błony wewnątrzustrojowe, zęby) a także funkcje jakie spełnia w bardzo ważnych procesach życiowych, jak i właściwości fizykochemiczne czy biologiczne, sprawiły, że jest on przedmiotem licznych badań naukowych. Na postępy w badaniach ogromny wpływ ma rozwój biologii molekularnej. Jeszcze 40 lat temu uważano że w organizmie ludzkim występuje tylko jeden typ kolagenu (kolagen I), dziś wiemy już, że w organizmie człowieka wyróżnia się 29 jego typów oraz niemalże tyle samo kolagenopodobnych peptydów.
Budowa kolagenu
Kolagen jest białkiem strukturalnym, zewnątrzkomórkowym i stanowi aż 1/3 masy białka w całym organizmie ludzkim. Ze względu na to, że stanowi on najważniejszy składnik macierzy zewnątrzkomórkowej, jest białkiem kluczowym, które odpowiada za elastyczność i wytrzymałość różnych struktur organizmu. Wyróżniamy 29 typów kolagenu, które zbudowane są z co najmniej 46 łańcuchów polipeptydowych.
Makroczasteczka kolagenu zbudowana jest z 3 lewoskrętnych łańcuchów polipeptydowych α, a każdy z nich zawiera średnio około 1050 aminokwasów, jednak ich długość waha się od 662 do 3152 aminokwasów. Łańcuchy te tworzą superhelisę, co oznacza że splatają się one wokół wspólnej osi w prawą stronę. Wspólna cechą wszystkich typów kolagenu jest występowanie struktury trójhelikalnej. Najczęściej powtarzającą się sekwencją w łańcuchu polipeptydowym kolagenu jest -Gly-X-Y-, gdzie Gly, czyli glicyna, stanowi co trzecią resztę aminokwasową, a X i Y to Pro czyli reszty proliny i Oh, czyli reszty hydroksyproliny (najczęściej 4-hydroksyprolina).
Długość potrójnej helisy wynosi 300nm i ma średnicę 1,5nm. Łańcuchy w superhelisie mogą być identyczne, wówczas tworzą homotrimery, przykładem jest kolagen III lub różnić się i tworzyć heterotrimery, tak jak to występuje w kolagenie VI.
Oprócz struktur trójhelikalnych w budowie kolagenu biorą udział fragmenty niehelikalne, czyli tzw. telopeptydy, występujące na końcach makrocząsteczek kolagenu lub są wbudowane w strukturę superhelisy. Telopeptydy odpowiadają przede wszystkim za immunogenność białka.
 Rys.1 Superhelisa.
Rys.1 Superhelisa.
Skład aminokwasowego kolagenu charakteryzuje się zawartością aminokwasów polarnych takich jak:
– ASP – kwas asparaginowy
– Glu – kwas glutaminowy
– Arg – arginina
– Lys – lizyna.
Warto zwrócić uwagę na fakt, że kolagen zawiera w przybliżeniu równomolowe ilości aminokwasów kwaśnych w stosunku do aminokwasów zasadowych.

Rys.2 Struktura kolagenu ludzkiego pod mikroskopem.
Nieodłącznym składnikiem kolagenu jest woda, która determinuje jego strukturę i aktywność biologiczną. W badaniach przeprowadzonych w 2008 r. w Instytucie Biostruktury we Włoszech wykazano, że stabilizacja superhelisy odbywa się poprzez interakcje łańcucha polipeptydowego z wodą. Interakcja ta możliwa jest tylko wówczas, gdy w sekwencji -Gly-X-Y- pozycję Y stanowi Pro-OH oraz gdy brzegi łańcucha zapełniane są resztami Arg. Elastyczność makrocząsteczek kolagenu zależy od ilości występujących załamań w jego strukturze, powstających ze względu na zakłócenia w regularnie przetwarzającej się sekwencji -Gly-X-Y-. Dodatkowo dowiedziono, że niezbędnym czynnikiem warunkującym stabilność struktury superhelisy jest obecność oddziaływań elektrostatycznych i sił van der Waalsa pomiędzy lizyną i kwasem asparginowym.
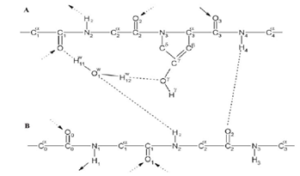
Rys.3 Stabilizacja struktury helikalnej kolagenu. Wiązania wodorowe między wodorem amidowym w pozycji 4 łańcucha A a tlenem karbolowym w pozycji 2 łańcucha B oraz pośredni udział wody w tworzeniu wiązań wodorowych między grupą 𝛄 hydroksylową Pro-OH w pozycji 3 łańcucha A a tlenem karboksylowym w pozycji 1 łańcucha A i wodorem amidowym w pozycji 2 łańcucha B.
Typy kolagenu
Aktualnie wyodrębnia się 29 odmiennych genetycznie typów kolagenu. Wielopostaciowość kolagenu nie jest do końca poznana, niektórzy naukowcy, jak Bailey i inni, uważają, że różnice między nimi wynikają z różnych długości części helikalnej makrocząsteczeki i występujących przerw w strukturze potrójnej helisy, a także wymiarów i kształtów domen globularnych oraz zmian w modyfikacjach post-translacyjnych. Myllyharju natomiast uważa, że są to różnice wynikające z ekspresji genów kodujących enzymy odpowiedzialne za biosyntezę tego białka.
Złożoność jak i różnorodność poszczególnych typów kolagenu wymusiła wprowadzenie odpowiedniej nomenklatury, jednak nazewnictwo nie jest w pełni usystematyzowane. Najczęściej używane oznaczenia dla poszczególnego typu kolagenu to numerowanie ich za pomocą cyfr rzymskich, a wchodzące w ich skład łańcuchy α cyframi arabskimi, przykład: α1(I) określa łańcuch α1 kolagenu typu I.
Pod względem właściwości strukturalnych, a także funkcji jaką pełnią poszczególne typy kolagenu, dzieli się je na:
| Kolageny fibrylarne | I, II, III, V, XI, XXIV, XXVII, |
| Kolagen błony podstawowej | IV, |
| Kolagen tworzący włókna kotwiczące | VII, |
| Multipleksyny | XV, XVIII, |
| Kolagen tworzący mikrowłókna | VI, |
| Kolageny tworzące heksagonalne układy sieciowe | VIII, X, |
| Kolageny FACITs (Fibril-Assiociated Collagens with Interrupted Triple helices) | IX, XII, XIV, XVI, XIX, XX, XXI, XXII, XXVI, |
| Kolageny zawierające domeny transmembranowe | XIII, XVII, XXIII, XXV, |
W skórze człowieka dominującym typem kolagenu jest kolagen I i stanowi on aż od 85 do 90%, stanowiąc włóknistą podporę skóry. Drugi z kolei jest kolagen III w ilości 10-15%, który oplata włókna zbudowane z kolagenu I i odpowiedzialny jest za ich prawidłowe rozmieszczenie i sprężystość. Co ciekawe kolagen typu II przeważa w skórze noworodków i płodu a także w tkance blizn. Śladowe ilości jakie wykryto w skórze człowieka to kolagen typu V, VI, VII, VIII, XII, XIII, XIV, XVI, XVII oraz XXIX.
Rozmieszczenie kolagenu w tkankach
| Typ | Występowanie |
| I | Skóra, kości, ścięgno, więzadło, rogówka, |
| II | Chrząstka, ciałko szkliste, |
| III | Skóra, naczynia, jelito, macica, |
| IV | Błony podstawowe, naczynia włosowate, |
| V | Kości, skóra, rogówka, łożysko, komórki Schwanna |
| VI | Kości, chrząstka,rogówka, skóra, naczynia |
| VII | Skóra, pęcherz, śluzówka, pępowina, owodnia |
| VIII | Błony Desement’s, naczynia, kości, mózg, serce, nerka, skóra, chrząstka, |
| IX | Chrząstka, rogówka, ciałko szkliste, |
| X | Chrząstka hipertroficzna, |
| XI | Chrząstka, dysk międzykręgowy, |
| XII | Skóra, ścięgno, chrząstka, |
| XIII | Komórka śródbłonka, skóra, oko, serce, mięsnie szkieletowe, |
| XIV | Naczynia, kości, skóra, chrzastka, oko, nerwy, ścięgno, macica, |
| XV | Naczynia kapilarne, skóra, łożysko, nerka, serce, jajniki, jądra, |
| XVI | Skóra, serce, nerka, mięśnie gładkie, |
| XVII | Skóra, m-RNA, |
| XVIII | Okołonaczyniowe błony podstawowe, nerka, wątroba, płuco, |
| XIX | Pas błon podstawowych w mięśniach szkieletowych, śledziona, gruczoł krokowy, nerka, wątroba, łożysko, okrężnica, skóra, |
| XX | Nabłonek rogówkowy, |
| XXI | Naczynia, serce, żołądek, nerka, mięśnie szkieletowe, łożysko, |
| XXII | Połączenia tkankowe, |
| XXIII | Serce, siatkówka, przerzutowe komórki rakotwórcze, |
| XXIV | Kości, rogówka, |
| XXV | Mózg, serce, oko, jądra, |
| XXVI | Jajniki, jądra, |
| XXVII | Chrząstka, |
| XXVIII | Komórki systemu nerwowego, |
| XXIX | Skóra. |
Biosynteza kolagenu
Synteza kolagenu w komórkach ssaków kodowana jest przez blisko 44 geny. U człowieka geny kodujące łańcuch α1(I) i α2(I) zlokalizowane są w chromosomie 17. Kolagen syntetyzowany jest w fibroblastach, (a w skład aminokwasów budujących go wchodzą wyłącznie aminokwasy endogenne), a także chondrocytach tkanki kostnej. W komórce biosynteza rozpoczyna się od produkcji łańcuchów α prokolagenu w rybosomach związanych z reticulum endoplazmatycznym. Kolejno za sprawą sekwencji sygnalnej w łańcuchach, prokolagen transportowany jest do siateczki śródplazmatycznej i tam zachodzi seria modyfikacji post-translacyjnych. Modyfikacje te, to hydroksylacja reszt proliny i lizyny, N- i O-glikozylacje, trimeryzacja, powstawanie wiązań disiarczkowych, izomeryzacja typu cis-trans oraz fałdowanie do postaci superhelisy. Następnie makrocząsteczki prokolagenu kierowane są do aparatu Golgiego gdzie zostają upakowane w pęcherzyki transportowe i wydzielane poza obręb komórki. Transformacja prokolagenu do kolagenu odbywa się na drodze enzymatycznej, pod wpływem metaloproteinaz należących do rodziny ADAMTS (A Disintegrin-like And Metalloprotease with Thrombospondin mortifs) i BMP-1.
W wyniku agregacji makrocząsteczek kolagenu powstają fibryle kolagenowe, tworzące włókna, a te tworzą pęczki włókien. Za trwałość i wytrzymałość struktury włóknistej odpowiadają poprzeczne, kowalencyjne wiązania sieciujące wewnątrz i między- cząsteczkowe, powstające na skutek działania oksydazy lizylowej. Kofaktorem dla oksydazy lizylowej jest lizylo-tyrozylochinon od którego zależy jej działanie, które zależy także od obecności jonów miedzi, które wchodzą w skład tego enzymu.
W organizmie kolagen ulega również biodegradacji, a dzieje się to w wyniku złożonego mechanizmu enzymatycznego, w który zaangażowane są metaloproteinazy zewnątrz komórkowe, takie jak MMP-1, MMP-2 oraz MMP-9, które przecinają wiązania peptydowe pomiędzy glicyną a leucyną i izoleucyną. W konsekwencji cząsteczki kolagenu rozpadają się do wielkocząsteczkowych produktów, a następnie cięte zostają na peptydy i aminokwasy przez nieswoiste enzymy proteolityczne. Kolagen ulega degradacji na drodze wewnątrzkomórkowej i na drodze fagocytozy w sytuacji gdy cząsteczka białka zostanie wchłonięta przez komórkę.
Rola kolagenu w skórze
Kolagen należy do białek strukturalnych, charakteryzujących się wysoką odpornością na czynniki fizyczne, chemiczne i mechaniczne. Dzięki temu jest on jednym z podstawowych budulców tkanki łącznej na poziomie komórkowym. Kolagen w organizmie, a co za tym idzie również w skórze, pełni rolę „kleju”. Oznacza to, że odpowiada on za spajanie ze sobą poszczególnych elementów tkanki, zapewniając jej w ten sposób całkowitą integralność.
Przykładem jest skóra właściwa, która złożona jest z tkanki łącznej, a od strony środowiska zewnętrznego pokryta jest tkanką nabłonkową, czyli naskórkiem. Za integralność tych dwóch tkanek odpowiada również białko kolagenowe. Cecha kolagenu w postaci tzw. kleju pozwala na zachowania spójności całego organizmu i umożliwia mu w ten sposób prawidłowe funkcjonowanie. Włókna kolagenu tworzą uporządkowaną sieć przestrzenną, do której przyłączane są inne elementy macierzy pozakomórkowej za pomocą, np. receptorów. Mechanizm ochronny przed uszkodzeniami mechanicznymi polega na tym, że w momencie działania bodźca, wyżej opisana sieć odkształca się, jednak w momencie gdy bodziec przestaje działać, cząsteczki bez problemu wracają na swoje pierwotne miejsce. Dzięki temu wszystkie elementy przyłączone do włókien kolagenowych, lub znajdujące się w sąsiedztwie, nie ulegają uszkodzeniu ze względu na uraz mechaniczny.
Ważną cechą kolagenu jest również zdolność wiązania wody. Dzięki odpowiedniemu poziomowi nawodnienia włókna białkowe skóry zachowują swoją strukturę oraz właściwości. Wysoki poziom nawodnienia w skórze właściwej i naskórku to klucz do prawidłowego jej funkcjonowanie, ze względu na to, że większość przemian biochemicznych zachodzi w środowisku wodnym. Liczne badania wskazują również, że cząsteczki kolagenu mają zdolność do wiązania cytokin. Pozwala to przypuszczać, że są one bardzo ważne w procesie proliferacji komórek (podziałów komórkowych),a proces ten jest niezwykle ważny w regeneracji ubytków skóry.
Bez wątpienia powyższe argumenty wskazują na to, że kolagen jest niezwykle ważnym białkiem dla organizmu człowieka. Umożliwia on tworzenie wysoce wyspecjalizowanych struktur tkankowych, a także zapewnia integralność narządów, uczestnicząc w sposób pośredni w procesach obronnych organizmu, utrzymując go w homeostazie. Z wiekiem w skórze spada tempo syntezy kolagenu, a także aktywność enzymów biorących udział w modyfikacjach posttranslacyjnych. Zmniejsza się również rozpuszczalność kolagenu, a włókna kolagenowe ulegają procesowi ścieńczenia. Z wiekiem wzrasta również udział ilościowy kolagenu III. Pod wpływem promieniowania ultrafioletowego (UV) obserwuje się pofragmentowanie włókien kolagenowych. Oprócz tego w badaniach zaobserwowano zaburzenia czynności fibroblastów, czego skutkiem jest spowolnienie syntezy i wymiany kolagenu, co może wpływać na słabe gojenie się ran u osób starszych. Odpowiedzialne za pojawienie się zmarszczek, nie jest tylko zmniejszenie ilości i jakości kolagenu, jak i elastyny w skórze, ale również zmniejszenie ilości redystrybucji podskórnej tkanki tłuszczowej i osłabienie mięśni twarzy.
Czy stosowanie nutriceutyków – czyli suplementów kolagenowych ma sens?
Przez wiele lat suplementacja doustna kolagenu stosowana była w celu profilaktyki schorzeń związanych z chorobami ortopedycznymi – schorzeniami tkanki łącznej, a dokładniej chrzęstno-stawowej. Od kilku lat obserwuje się zdecydowany wzrost preparatów kolagenowych, które rekomendowane są przez koncerny farmaceutyczne jako środki wspomagające wygląd i stan naszej skóry, a co za tym idzie jako suplementy opóźniające efekty starzenia się skóry. W Europie suplementy te tak naprawdę dopiero raczkują w porównaniu, np. z rynkiem azjatyckim (np. Japonią), gdzie stanowią one znacząca grupę dobrze sprzedających się nutriceutyków.
Za miejsce, w którym jego mieszkańcy cieszą się długim życiem, według WHO jest Japońska wyspa Okinawa. Miano najzdrowszego miejsca na ziemi wyspa ta zyskała nie bez powodu. Statystki mówią, że żyje na niej około 450 osób, które przekroczyły 100. rok życia. Zaskakujące, prawda?
W wyniku tych obserwacji zostały rozpoczęte badania, które trwały ponad 25 lat, a ich celem było poznanie tajemnicy długowieczności okinawskich mieszkańców. Program badawczy znany był jako „Studia nad okinawskimi stulatkami”. Ku zaskoczeniu naukowców, nie odkryto żadnego tajemniczego genu, jaki miałby występować w badanej populacji. Przeanalizowano więc styl życia i dietę najstarszych mieszkańców. W podsumowaniu badań profesor Makoto Suzuki, Bradley J.Willcox i Craig Willcox stwierdzili, że eliksirem młodości jest niskokaloryczna dieta oraz styl życia mocno związany z naturalnym środowiskiem. Prowadzona przez nich dieta oscylowała pomiędzy 1500-1900 kcal na dobę, jednak najważniejsza była nie sama kaloryka, co gęstość spożywanego jedzenia.
Podział produktów ze względu na gęstość energetyczną:
bardzo niska: < 60 kcal/ 100 g – warzywa i owoce, niektóre niezabielane zupy;
niska: 60 – 140 kcal/ 100 g – ziemniaki, chude mięsa, strączki, zboża;
umiarkowana: 150 – 400 kcal/ 100 g – owoce suszone, cukier, tłuste mięso, tłusty nabiał-np. ser żółty chleb pełnoziarnisty;
wysoka: 400 > kcal/ 100 g – słodycze, tłuszcze roślinne i zwierzęce, orzechy, pestki.
Analiza jadłospisów wykazała że do najczęściej spożywanych dań przez tych Japończyków należą:
– Tebichi – świńskie nogi gotowane w wywarze warzywnym,
– wodorosty kombu,
– rzodkiew daikon
– świńskie uszy w occie,
– zupy robione na wywarach ze świńskich nóg lub żoładków i jelit
– jedzą sporo grzybów, wodorostów i orzechów.
Jak więc można zauważyć, dieta okinawskich mieszkańców obfituje w dania bogate w kolagen.
Pomimo prowadzonych badań na temat suplementacji tego tak ważnego dla nas białka, literatura wciąż jest uboga. Pierwsze publikacje jakie się pojawiały dotyczyły badań in vitro na liniach komórkowych, opisując wzmożoną syntezę kolagenu przez fibroblasty, poprzez wpływ poszczególnych aminokwasów, które wchodziły w skład kolagenu (argininy, glicyny, hydroksyproliny), a także wzrost proliferacji komórek skóry i syntezy kolagenu pod wpływem hydroksyproliny.
W badaniach na ludziach z kolei wykazano, że po spożyciu produktów z żelatyną odnotowano znaczący wzrost stężenia peptydów pochodzących z trawienia kolagenu, opornych na działanie peptydaz dipeptydu Pro-Hyp (4 godziny po spożyciu). Badanym podawano hydrolizat żelatyny pochodzący ze świńskiej skóry, z kurzych łapek i chrząstek, po 12 godzinnym poście. Przed spożyciem zbadano krew i wykazano nieznaczne ilości hydroksyproliny w osoczu. Po podaniu doustnym hydrolizatu, po upływie 1-2 godzin powtórzono badania i wykazano że poziom hydroksyproliny znacznie wzrósł osiągając poziom 20-60 nmoli/ml. W surowicy zidentyfikowano składniki peptydów kolagenowych pochodzących ze spożytej żelatyny, takie jak: głównie Pro-Hyp (w ilości 2560nmol/ml) oraz małe, lecz znaczące ilości: Ala-Hyp, Ala-Hyp-Gly, Pro-Hyp-Gly, Leu-Hyp, Ile-Hyp, Phe-Hyp.
| Pro-Hyp-Gly
Pro-Hyp |
Wykazują aktywność chemotaktyczną do fibroblastów |
| Asp-Gly-Glu-Ala | Pobudzają osteoblasty i geny w komórkach szpiku kostnego |
| Ala-Hyp Gly-Pro-Val |
Hamują enzym konwertujący angiotensynę |
| Gly-Pro-Hyp | Sugeruje się, że bierze udział w agregacji płytek krwi |
Badania in vitro wykazały znaczny wzrost fibroblastów pobranych ze skóry u myszy, w wyniku stymulacji za pośrednictwem Pro-Hyp. Nowe badania prowadzone in vivo na szczurach potwierdzają pozytywny wpływ kolagenu suplementowanego codziennie na białka macierzy zewnątrzkomórkowej. W tym badaniu zaobserwowano znaczący wzrost kolagenu I oraz IV po zastosowaniu suplementacji, przy równoczesnym obniżeniu się proenzymu, aktywnej formy kolagenezy 1 , enzymu odpowiedzialnego za degradację badanego białka. Ponadto stwierdzono, że produkty hydrolizy kolagenu mogą wpływać na złagodzenie stresu oksydacyjnego.
Kolejne randomizowane badanie przeprowadzone na grupie 69 kobiet w wieku 35-55 lat badało, czy poprawie ulegnie elastyczność i nawilżenie skóry, szorstkość skóry i transepidermalna utrata wody. Kobiety podzielone były na 3 grupy: 2 grupy badane, w których kobiety przyjmowały 2,5g lub 5g hydrolizatu kolagenu typu I pochodzenia wołowego, oraz grupę kontrolną, która otrzymywała placebo. Badanie trwało 8 tygodni.

Rys. 4 Wykres zmian elastyczności skóry, w stosunku do wieku badanej i czasu suplementacji.

Rys. 5 Wykres długotrwałej zmiany elastyczności skóry w stosunku do wieku i dawki suplementacji.
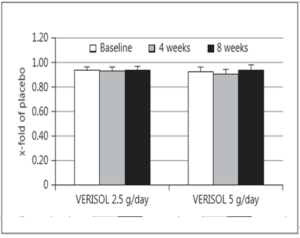
Rys. 6 Wykres zmian nawilżenia skóry w stosunku do dawki suplementacji.
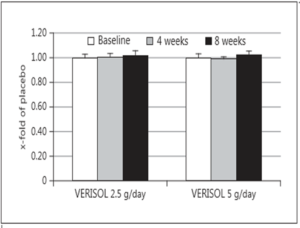 Rys. 7 Wykres zmian transepidermalnej utraty wody w stosunku do dawki suplementacji.
Rys. 7 Wykres zmian transepidermalnej utraty wody w stosunku do dawki suplementacji.
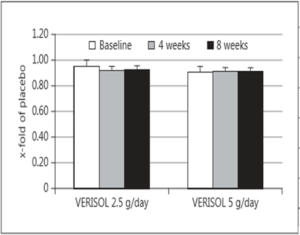
Rys. 8 Wykres zmian w szorstkości skóry w stosunku do dawki suplementacji.
Przeprowadzone badanie potwierdziło zmianę istotną statystycznie w elastyczności skóry u badanych kobiet w czasie suplementacji zarówno 2,5g jak i 5g hydrolizatu kolagenu wołowego w czasie 4 vs 8 tygodni przyjmowania suplementu. U niektórych badanych wykazano, że elastyczność skóry wzrosła aż o 30%, a była ona zauważana w grupie starszych kobiet.
Otrzymany wynik nawilżenia skóry nie był istotny statystycznie, natomiast zmian w transepidermalnej utracie wody a także szorstkości skóry nie zauważono.
W przeszłości wykonywano również badania dotyczące skuteczności hydrolizatów kolagenu pochodzenia wieprzowego (ze skóry świń), a także rybnego (łusek/skóry ryb).

AUC dla kolagenu pochodzącego z rybich łusek była znacząco wyższa w porównaniu do skóry ryb czy świń.
Ala-Hyp, Leu-Hyp, Ile-Hyp, Phe-Hyp i Pro-Hyp-Gly wykryto tylko dla hydrolizatów pochodzących z ryb, co sugeruje, że aktywność fizjologiczna kolagenu pochodząca z żywności zależy od jego pochodzenia.
Najnowsze badania opublikowane w styczniu 2020 roku również potwierdziły skuteczność zażywania hydrolizatu kolagenu. W badaniu zastosowano hydrolizat pochodzący ze skóry ryb, a także witaminę C, metylosulfonylometan (MSM), witaminy z grupy B, organiczne siemię lniane, L-lizynę. Badanie trwało 8 tygodni i wykazało, że suplementacja tym preparatem kolagenowym wpłynęła korzystnie na ekspresję enzymów kluczowych w syntezie kwasu hialuronowego i indukuje ona syntezę kolagenu na poziomie mRNA białka, a także produkcję silniejszych włókien kolagenu. Wzrost obserwuje się również w ilości fibroblastów skóry a także indukowana jest ich migracja.


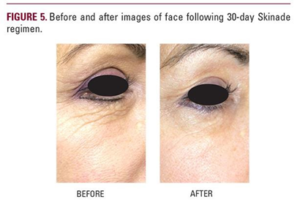
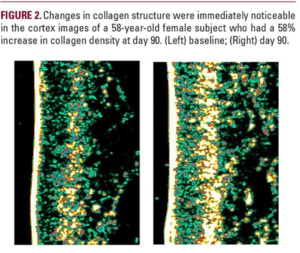
Podsumowanie
Wszystkie wspomniane powyżej badania potwierdzają skuteczność stosowania nutriceutyków na bazie hydrolizatu kolagenu. Należy jednak zwrócić uwagę, na pochodzenie hydrolizatu w danym preparacie, a także, czy jest on wzbogacony dodatkowo w inne składniki odżywcze.
W czasie licznych dyskusji na temat słuszności przyjmowania preparatów z kolagenem spotkałam się z opinią, że „nie ma sensu przyjmować suplementów kolagenowych gdyż cząsteczka kolagenu jest zbyt duża by była wchłonięta”.
Jak więc możliwym jest, że w osoczu krwi w tylu badaniach wykryto peptydy kolagenowe?
Związki kolagenu wykorzystywane w suplementach doustnych są rozkładane na peptydy poprzez hydrolizę enzymów, tworząc w ten sposób cząstki o niższej masie cząsteczkowej, które łatwiej wchłaniane są do krwioobiegu. Ich obecność w tkance skóry stymuluje natomiast fibroblasty i aktywuje przemiany biochemiczne odpowiedzialnych za syntezę nowych włókien kolagenowych i kwasu hialuronowego.
MGR Katarzyna Klatka
Bibliografia:
- Schoulders MD, Raines RT: Collagen structure and stability. Annu Rev Biochem 2009;78:929-58. 2. Ricard-Blum S: The collagen family. Cold Spring Harb Perspect Biol 2011 1;3(1).
- Gordon MK, Hahn RA: Collagens. Cell Tissue Res 2010;339(1):247–57.
- Deal, C.L. and Moskowitz, R.W. Nutraceuticals as therapeutic agents in osteoarthritis. The role of glucosamine, chondroitin sulfate, and collagen hydrolysate. Rheum Dis Clin North Am. 1999; 25: 379–395.
- Ohara, H., Matsumoto, H., Ito, K., Iwai, K., and Sato, K. Comparison of quantity and structures of hydroxyproline-containing peptides in human blood after oral ingestion of gelatin hydrolysates from different sources. J Agric Food Chem. 2007; 55: 1532–1535.
- Moskowitz, R.W. Role of collagen hydrolysate in bone and joint disease. Semin Arthritis Rheum. 2000; 30: 87–99.
- A. Gkouvi, A. Corbo and S. Gregoriou, Treatment of male genital lichen sclerosus with heterologous type I collagen, Clinical and Experimental Dermatology, 45, 3, 388-390.
- Lin Wang, Xiaoxiao Wang, Fan Bai, Yong Fang, Jinlin Wang and Ruichang Gao, The anti-skin-aging effect of oral administration of gelatin from the swim bladder of Amur sturgeon ( Acipenser schrenckii ) , Food & Function, 10.1039/C9FO00661C.
- Zehua Liu, Yuqi Li, Hongdong Song, Juan He, Ge Li, Yayao Zheng and Bo Li, Collagen peptides promote photoaging skin cell repair by activating the TGF-β/Smad pathway and depressing collagen degradation, Food & Function, 10.1039/C9FO00610A.
- Kenji Sato, Shiro Jimi and Masashi Kusubata, Generation of bioactive prolyl‐hydroxyproline (Pro‐Hyp) by oral administration of collagen hydrolysate and degradation of endogenous collagen, International Journal of Food Science & Technology, 54, 6, 1976-1980.
- Masashi Morifuji, The beneficial role of functional food components in mitigating ultraviolet‐induced skin damage, Experimental Dermatology, 28, S1, 28-31.
- Silver F.H., Christiansen D.L.: Biomaterials Science and Biocompatibility,Springer-Verlag New York, 1999, s. 9-26, 62-68.
- Simone A., Vitagliano L., Berisio R.: Role of hydration in collagen triple helixstabilization. Biochem. Biophys. Res. Commun. 372, 121-125.
- Brinckmann J., Notbohm H., Müller P.K.: Collagen. Primer in Structure, Processingand Assembly, Springer 2005, s. 1-13, 35-77, 86-110.
- Ricard-Blum S., Ruggiero F.: The collagen superfamily: from the extracellularmatrix to the cell membrane.Pathol. Biol. 2005, 53, 430-442.
- Heino J.: The collagen family members as cell adhesion proteins. BioEssays. 2007, 29,1001-1010.
- Sato K, Shigemura Y: Effect of marine collagen peptides on skin conditions W: Marine Cosmeceuticals: Trends and Prospects, CRC Press, Taylor & Francis Group, LCC, Boca Raton, 2011:125-132.
- Söderhäll C., Marenholz I., Kerscher T., Rüschendorf F., Esparza-GordilloJ., et al.: Variants in a Novel Epidermal Collagen Gene (COL29A1) Are Associated with Atopic Dermatitis. PLoS Biology 5,2007, 1952-1961.
- Bailey A.J., Paul R.G.: Collagen: a not so simple protein. J. Soc. LeatherTechnol. Chem.1998, 83, 104-10.
- Shigemura Y, Iwai K, Morimatsu F, Iwamoto T, Mori T, Oda C, Taira T, Park EY, Nakamura Y, Sato K: Effect of prolyl-hydroxyproline (Pro-Hyp), a food-derived collagen peptide in human blood on growth of fibroblasts from mouse skin. J Agric Food Chem 2009;57(2):444-9.
- Iwai K, Hasegawa T, Taguchi Y, Morimatsu F, Sato K, Nakamura Y, Higahsi A, Kido Y, Nakabo Y, Otsuki K: Identification of food-derived collagen peptides in human blood after oral administration of gelatin hydrolisate. J Agric Food Chem 2005;53(16):6531-6.
- Nakatani S, Mano H, Sampei C, Shimizu J, Wada S: Chondroprotective effect of bioactive peptide prolylhydroxyproline in mouse articular cartilage in vitro and in vivo. Osteoarthritis Cartilage 2009;17(12):1620-7.
- Myllyharju J., Kivirikko K.I.: Collagens, modifying enzymes and their mutations in humans, flies and worms. Trends Genet.2004, 20, 33-43.
- Huxley-Jones J., Robertson D.L., Boot-Handford R.P.: On the origins of the extracellular matrix in vertebrates. Matrix Biol. 2007, 26, 2-11.
- Ichikawa S, Morifuji M, Ohara M, Matsumoto H, Takeuchi Y, Sato K: Hydroxyproline containing dipeptides and tripeptides quantified at high concentrationin human blood after oral administration of gelatin hydrolisate. Int J Food Sci Nutr 2010;61(1):52-60.
- Smalls LK, Randall WR, Visscher MO: Effect of dermal thickness, tissue composition, and body site on skin biomechanical properties. Skin Res Technol 2006; 12: 43–49.
- Calleja-Agius J, Muscat-Baron Y, Brincat MP: Skin ageing. Menopause Int 2007; 13: 60–64.
- Ohara H, Matsumoto H, Ito K, Iwai K, Sato K: Comparison of quantity and structures of hydroxyproline-containing peptides in human blood after oral ingestion of gelatin hydrolysates from different sources. J Agric Food Chem 2007; 55: 1532–1535.
- Iwai K, Hasegawa T, Taguchi Y, Morimatsu F, Sato K, Nakamura Y, Higashi A, Kido Y, Nakabo Y, Ohtsuki K: Identification of food-derived collagen peptides in human blood after oral ingestion of gelatin hydrolysates. J Agric Food Chem 2005; 53: 6531–6536.
- E. Proksch, D. Segger, J. Degwert, M. Schunck, V. Zague, S. Oesser:Oral Supplementation of Specific Collagen Peptides Has Beneficial Effects on Human Skin Physiology: A Double-Blind, Placebo-Controlled Study. Skin Pharmacol Physiol 2014;27:47–55.
- Zague V, Freitas V, Costa Rosa M, Castro GA, Jaeger RG, Machado-Santelli GM: Collagen hydrolysate intake increases skin collagen expression and suppresses matrix metalloproteinase 2 activity. J Med Food 2011;14(6):618- 24.
- Liang J, Pei X, Zhang Z, Wang N, Wang J, Li Y: The protective effects of long-term oral administration of marine collagen hydrolysate from chum salmon on collagen matrix homeostasis in the chronological aged skin of Sprague-Dawley male rats. J Food Sci 2010;75 (8):H230-8.
- Patel N, Padhtrare D, Saudagar R. Newer trends in cosmetology. World J Pharm Pharmaceutical Sci. 2015;4(3):483–502.
- Asserin J, Lati, E, Shioya B, Prawitt J. The effect of oral collagen peptide supplementation on skin moisture and the dermal collagen network: Evidence from an ex vivo model and randomized, placebo-controlled clinical trials. J Cosmet Dermatol. 2015;14(4):291–301.
- Halper J, Kjaer M. Basic components of connective tissues and extracellular matrix: Elastin, fibrillin, fibulins, fibrinogen, fibronectin, laminin, tenascins and thrombospondins. Adv Exp Med Biol. 2014;802:34–47.
- Buonocore D, Lazzeretti A, Tocabens P, et al. Resveratrol–procyanidin blend: nutraceutical and antiaging efficacy evaluated in a placebo-controlled, double-blind study. Clin Cosmet Investig Dermatol. 2012;5:159–65.
- Mount Sinai. Vitamin H (Biotin). Online document at: www.mountsinai.org/ health-library/supplement/vitamin-h-biotin.
- Souken Laboratories. Double-Blind Placebo-Controlled Trial of Oral Supplementation of Peptan Collagen Peptides in Improving Skin Condition: Study YNTKK–2008–4144.
- Kathy L. Anderson. Clinical Evidence of the Anti-Aging Effects of a Collagen Peptide Nutraceutical Drink on the Skin. JDD 2020;19(1Suppl); 5-10.
- Marina Offengenden, Subhadeep Chakrabarti and Jianping Wu, Chicken collagen hydrolysates differentially mediate anti-inflammatory activity and type I collagen synthesis on human dermal fibroblasts, Food Science and Human Wellness, 10.1016/j.fshw.2018.02.002, 7, 2, 138-147.